L’électrolyse alcaline, observée pour la première fois le 2 mai 1800, est une méthode de production d’hydrogène consiste à séparer l’oxygène et l’hydrogène de l’eau par un courant électrique dans une solution alcaline.
La première électrolyse a été une électrolyse alcaline. Le 2 mai 1800, quelques semaines après l’invention de la pile par Alexandro Volta, William Nicholson et Sir Anthony Carlisle, reproduisirent ladite pile et plongèrent deux fils de cuivre reliés à la pile dans l’eau.
Ils observèrent alors “un petit courant de bulles très fines partant de la pointe du fil de cuivre communiquant avec l’extrémité argent de la pile”. C’était la première électrolyse (qui était aussi une électrolyse alcaline).
[Débat: selon Trasatti S. Water electrolysis: who first? Journal of Electroanalytical Chemistry Oct 1999;476(1):90e1., repris par beaucoup, c’est Troostwijk and Diemann qui auraient découvert la première en 1789.]
Nous approfondirons le principe de l’électrolyse alcaline, présenterons quelques dates importantes de son évolution et enfin nous en étudierons les dimensions pratiques (prix, efficacité …).
Le principe de l’électrolyse alcaline
La réaction se produisant à l’anode est la suivante :
2 OH− → H2O + 1/2 O2 + 2e−
La réaction à la cathode est:
2 H2O + 2e− → H2 + 2 OH−
Voilà un schéma. Notez le diaphragme, perméable à l’eau, mais imperméable aux gaz, qui sert à bien séparer les deux gaz :

L’électrolyte est un liquide dont le rôle va être de servir de « milieu » pour que se produise la réaction.
Il s’agit en principe d’une solution d’hydrogyde de potassium (potasse, KOH) dont la concentration varie en fonction de la température (25% à 80°C jusque 40% à 160°C). (Guenot 2017)
Le problème de l’intermittence
L’un des gros problèmes de l’électrolyse alcaline est son inertie, ce qui la rend (en principe) impossible à coupler à une énergie intermittente.
« L’inertie de l’électrolyte alcalin, liée à la faible mobilité des ions hydroxydes et aux fortes concentrations utilisées, impose une utilisation en régime stationnaire pour des performances optimales. Ce système ne paraît pas adapté à la captation des énergies intermittentes. »
Guenot 2017
« De plus, à cause de l’utilisation d’un électrolyte liquide, cette technique peut difficilement être couplée à une source d’énergie intermittente (problèmes liés à la gestion thermique et à la modification de la conductivité de l’électrolyte lors de la mise en régime dans les périodes d’arrêt/démarrage et de variation de charge). »
Caroline Rozain 2013
L’activation magnétique de l’électrolyse alcaline
L’une des raisons pour lesquelles l’électrolyse alcaline est peu compatible avec les énergies intermittentes est que le système doit rester à 80°C.
Pour répondre à ce problème, des chercheurs du LEPMI (Laboratoire d’Electrochimie et de Physicochimie des Matériaux et des Interfaces) ont très recemment (2018) développé « l’activation magnétique« .
Cela consisterait à cibler le chauffage de l’électrolyseur là où il est nécessaire à l’aide d’un matériau magnétiquement sensible, qui chaufferait lorsqu’il est immergé dans un champs magnétique. C’est un peu le principe du micro-onde.
« […] nous avons donc développé un catalyseur composé de nanoparticules de carbure de fer, revêtues d’une couche de nickel. Cette architecture permet de chauffer le cœur du catalyseur, dont la nature est choisie en fonction de la température maximale que l’on souhaite atteindre, et donc d’atteindre une température en surface du catalyseur contrôlée et beaucoup plus élevée qu’en électrolyse classique. »
Marian Chatenet, chercheuse au LEPMI
Voici le schéma :
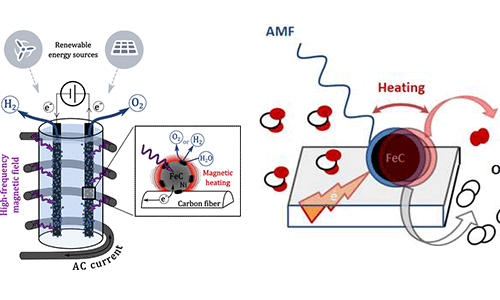
Un démonstrateur, réalisé avec le soutien du groupe Engie, aurait déjà apporté une preuve du concept. Le projet ANR Hy-walHy a pour objet de préparer une production industrielle du procédé.
Quelques dates de l’électrolyse alcaline
Repères technologiques
La découverte
- 2 mai 1800: Découverte de l’électrolyse alcaline par William Nicholson et Sir Anthony Carlisle.
- Fin mai 1800: Humphry Davy décrit les variations d’acidité et de basicité près des électrodes dans un mémoire sur l’électrolyse de l’eau.
- 1833: Michael Faraday, élève de Davy, découvre la constante Faraday, d’une valeur de 96 500 coulombs. Il fixe également la nomenclature électrochimique : électrolyte, électrodes, anode, cathode, ions, cations et anions. (rien que ça !)
- Johan Hittorf
- 1884: Svante Arrhenius publie la Théorie chimique des électrolyse,
Premiers brevets
- 20 novembre 1888: Dépôt du premier brevet sur l’électrolyse de l’eau par Latchinoff, conseiller d’Etat à Saint-Petersbourg. Il avait déjà notamment le principe du diaphragme et de l’électrolyse sous pression.
- 1889: Hermann Nernst découvre la « formule de Nernst » , on est déduite la célèbre échelle de pH ainsi que, par Haber, la tension théorique de décomposition de l’eau (1.23 volts).
- 18 octobre 1890: Dépôt du second brevet par Charles Renard sur « des cellules cylindriques monopolaires de 3.5m de hauteur, de 300 mm de diamètre, avec des électrodes de fer, de puissance unitaire 0.81kW (2,7 V sous 300A)« .
- 1892: Dépôt du troisième brevet par l’Italien P.Garuti dont l’idée est d’utiliser les électrolyseurs à eau pour récupérer l’énergie disponible en heure creuse. Ils agiraient comme « régulateurs ».
- 1899: Brevet d’un électrolyseur à eau de type « filtre-presse » (« modèle Schmitt 1899 »; « modèle Oerlikon »). Après cession à un industriel, le modèle connaître un succès commercial rapide, vendant 400 appareils (puissance 2 à 38 kW) en 20 ans.
Développements industriels
- Années 1920: Développement de l’électrolyseur Pechkranz, qui va évincer le modèle Oerlikon. Les plus gros modèles peuvent avoir une puissance maximale de 875 kW.
- Activation nickel-souffre
- 1925-1940: premiers essais, infructueux, d’électrolyse sous pression par Noggerat et Neiderreiher Lawaczech.
- 1942: Mise au point du PTFE par Du Pont de Nemours
- 1951: Zdansky met au point pour l’entreprise suisse Lonza un prototype comportant 25 cellules d’1,6 mètres de diamètre, de 13mm d’épaisseur et fonctionnant sous 30 bars.
- 1955: Première installation d’ampleur d’électrolyse sous pression au Pérou, avec 27.2MW.
- 1978: Date à laquelle Alsthom, Creusot-Loire et CEM ont présenté un projet d’usine d’électrolyse avancée (= plus haute température / pression) de 300MW en 1978. Ils présenteront des projets fonctionnant respectivement à 120-140°, 160-180° et 200°C.
- 2018: Mise au point de l’activation magnétique de l’électrolyse alcaline.
Repères industriels
Premières usines
- 1900: 6 installations du modèle d’électrolyseur de P.Garuti fonctionnent en Europe (4m3/heure pour celle de Lucerne en Suisse), principalement pour alimenter les besoins de la soudure oxhydrique.
- 1912: première grande installation de cellules monopolaires (« Knowles Cell »), notamment pour répondre aux besoins du développement de l’hydrogénation des corps gras. Ils vendront au total 205MW de ces mêmes modèles entre … 1922 et 1972.
- 1913: Application industrielle du procédé Haber-Bosch (production d’ammoniac à partir d’hydrogène et de diazote, pour faire des engrais de synthèse), qui va démultiplier le besoin en dihydrogène. Encore aujourd’hui, c’est la principale utilisation de l’hydrogène.
- Années 1910: Pionniers de l’industrie de l’ammoniaque, Casale et Fauser, développent de nombreuses unités d’électrolyse de l’eau (>99MW).
Montée en puissance
- 1926-1927: 176 MW d’électrolyseurs Pechkranz sont installés.
- 1927: La société Norks-Hydro installe 120MW d’électrolyseurs Pechkranz à Vemork en Norvège. Le site marquera l’histoire à deux égards : sa puissance (300MW) était encore inégalée en 1996 et l’usine a été un enjeu de la « Bataille de l’eau lourde » en 1944-45.
Fin de la guerre et apparition du réformage
- La fin de la guerre amène le développement de nombreuses grandes installations (Norvège : 165 et 40MW par NorskHydro ; Nangal en Inde : 210MW par De Nora; Assouan en Egypte 200MW par Demag). Toutefois, le développement de la gazéification et du réformage d’hydrocarbure rétrécit brutalement le marché.
- Années 70: Développement de la recherche pour une électrolyse avancée en France, impulsée par EDF et la volonté d’avoir un vecteur d’énergie pour optimiser / réguler le réseau électrique. Néanmoins, le projet avortera dans les années 90 en raison de la concurrence de l’hydrogène fossile :
« […] le bilan technico-économique immédiat et prospectif réalisé fin 1994 est sombre pour le développement prévisible de la filière dans le contexte français. Seule une taxation forte et généralisée du rejet de CO2 fossile dans l’atmosphère apparaît à même de remettre les divers procédés de fabrication à niveau (typiquement une taxe de l’ordre de 50 $/tonne de CO2 telle qu’elle commence à être prise en compte dans certains pays). Pour ces raisons, la décision est prise d’arrêter le développement en cours. Dans la foulée, le démantèlement des unités d’essais de Pont-de-Claix et de Wazier commence au début de 1995. »
Christian Bailleux, Histoire de l’électrolyse alcaline de l’eau de ses débuts à nos jours
Dimensions pratiques de l’électrolyse alcaline
L’électrolyse alcaline est la forme la plus mature et ne nécessite pas de matériaux couteux.
Innovations
L’électrolyseur (alcalin ?) sHYp permettrait de produire de l’hydrogène à partir d’eau de mer ou de saumure
- sans utiliser de membrane
- en étant adapté à l’intermittence
- en consommant 50% moins d’énergie (par rapport à … ?)
Je suis très dubitatif de ces allégations, la startup étant très imprécise dans sa vidéo et ne parlant à aucun moment de son procédé.
Pour aller plus loin
- Benoît Guenot. Étude de matériaux catalytiques pour la conversion électrochimique de l’énergie. Chimie. Univ. Montpellier, 2017. Français.
- K. Rajeshwar, R. McConnell, S. Licht, Solar Hydrogen Generation. Toward A Renewable Energy Future. New York, Springer-Verlag, 2008.
- Bailleux Christian. Histoire de l’électrolyse alcaline de l’eau de ses débuts à nos jours. In: Bulletin d’histoire de l’électricité, n°27, juin 1996. Numéro spécial réalisé avec le concours de la Direction des études et recherches d’EDF. pp. 19-33. DOI : https://doi.org/10.3406/helec.1996.1310
- Caroline Rozain. Développement de nouveaux matériaux d’électrodes pour la production d’hydrogène par électrolyse de l’eau. Autre. Université Paris Sud – Paris XI, 2013. Français.
Cet article fait partie de notre dossier “Hydrogène, autonomie et transition énergétique“.
Pour approfondir ce sujet et voir les autres types d’électrolyses, vous pouvez consulter nos articles sur l’électrolyse et sur son histoire.
